多抗的纯化是一件比较简单的事情,因为人工干预比较大,所以对实验者的操作依赖性较强。很多新手觉得这是一件比较复杂困难的工作,但是如果理解了原理,就可以自行改进实验了。多抗纯化方法比较多,过去有用盐析法纯化的,有用辛酸-硫酸铵沉淀的方式纯化的,也有用冷酒精沉淀的方式纯化的,也有后来的离子交换层析和Protein A,G,A/G纯化的,但是在今天,市场上几乎所有的抗体都是通过抗原亲和纯化得到的,与其它方法相比,抗原亲和层析得到的抗体效率高、产量高、产品纯、操作简单。鉴于很多网友问起这方面的问题,我就详细地讲一讲亲和纯化原理和操作。
说到亲和层析,还得从上个世纪60年代说起。当年美国NIH(National Institutes of Health)有个学生在研究一种酶和抑制剂之间的相互作用的时候,突发奇想:既然此酶可以和抑制剂结合,那如果把抑制剂固定起来,不就可以用来纯化酶了吗?试了一下觉得果然可行于是发了一Paper,从那之后,就出现了各种各样的亲和层析,亲和配基与配体可以是酶与底物、酶与抑制剂、激素与受体、抗原和抗体、糖蛋白与凝集素、生物素与亲和素、组氨酸与二价金属离子、卟啉环与亚铁离子等。亲和层析精髓:将一种分子固定,用来吸附另一种特异性分子,最后将其洗脱下来。
言规正传,多抗的亲和层析是基于抗原与抗体结合的一种层析方式。基本思路是将抗原固定在一种基质(也就是柱的填料,大家都叫beads)上,然后与抗血清孵育以捕获相应的抗体,然后从基质上洗掉非特异性结合的抗体,最后再将抗体洗脱下来。一个经典的亲和纯化流程如下:
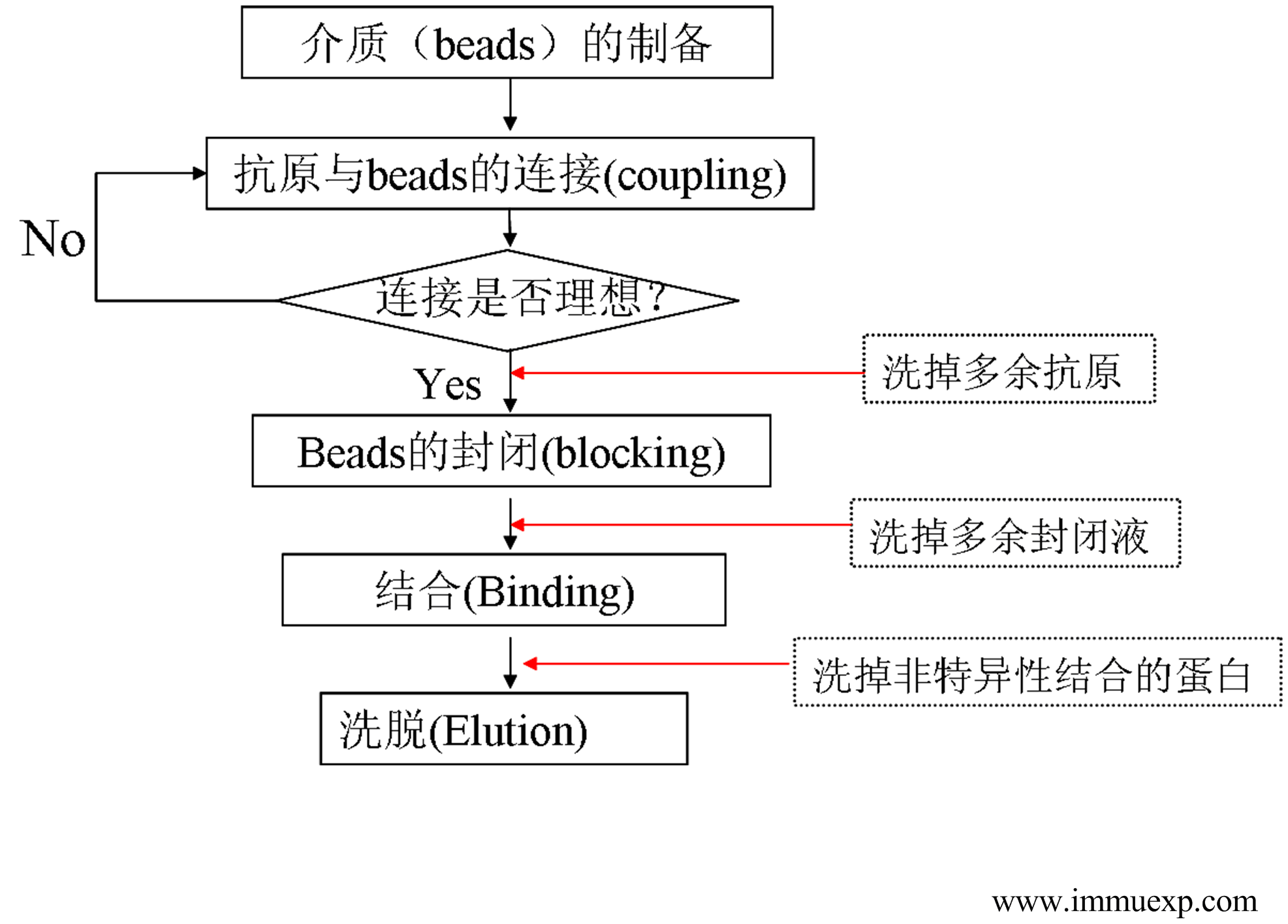
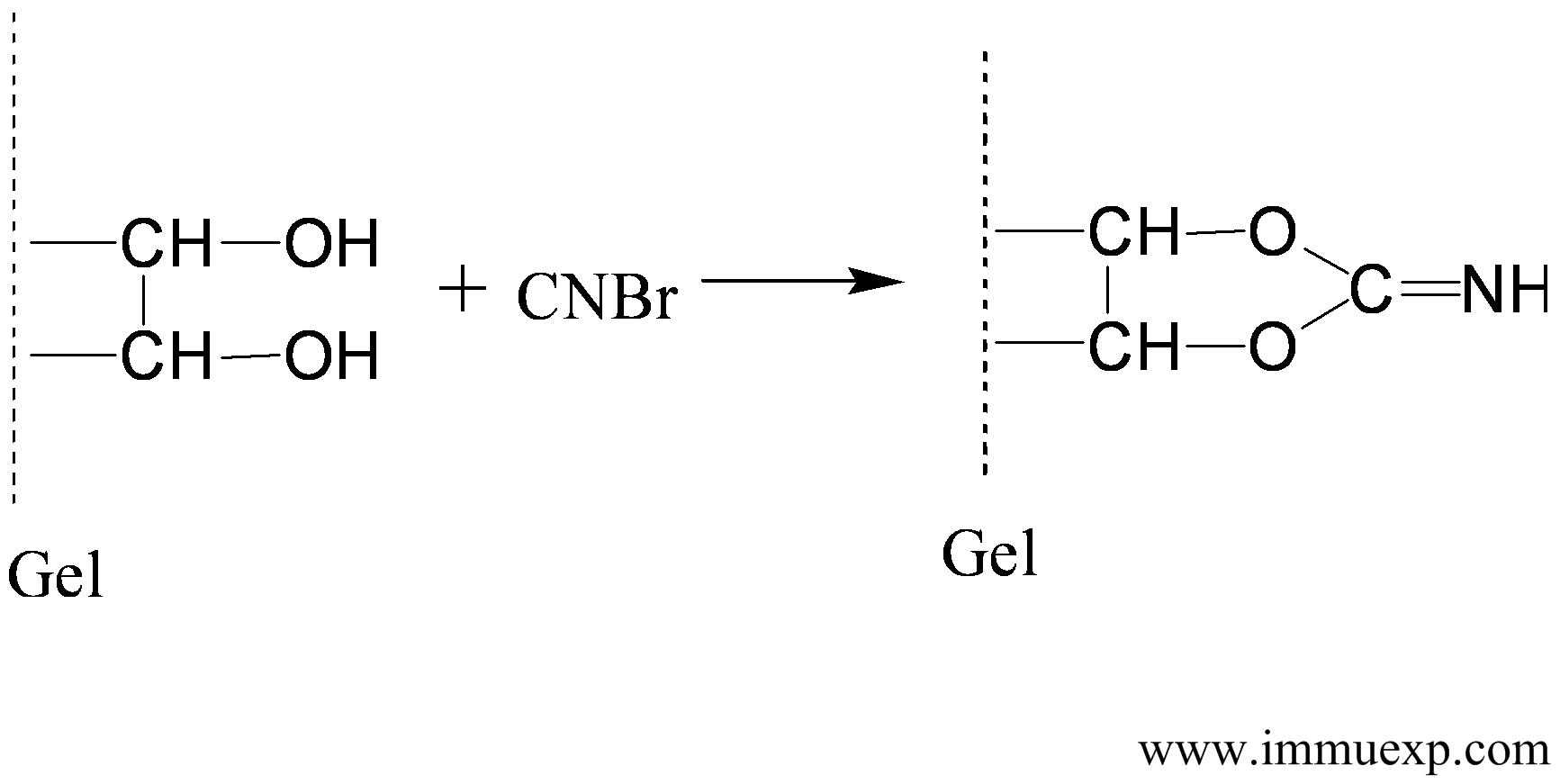
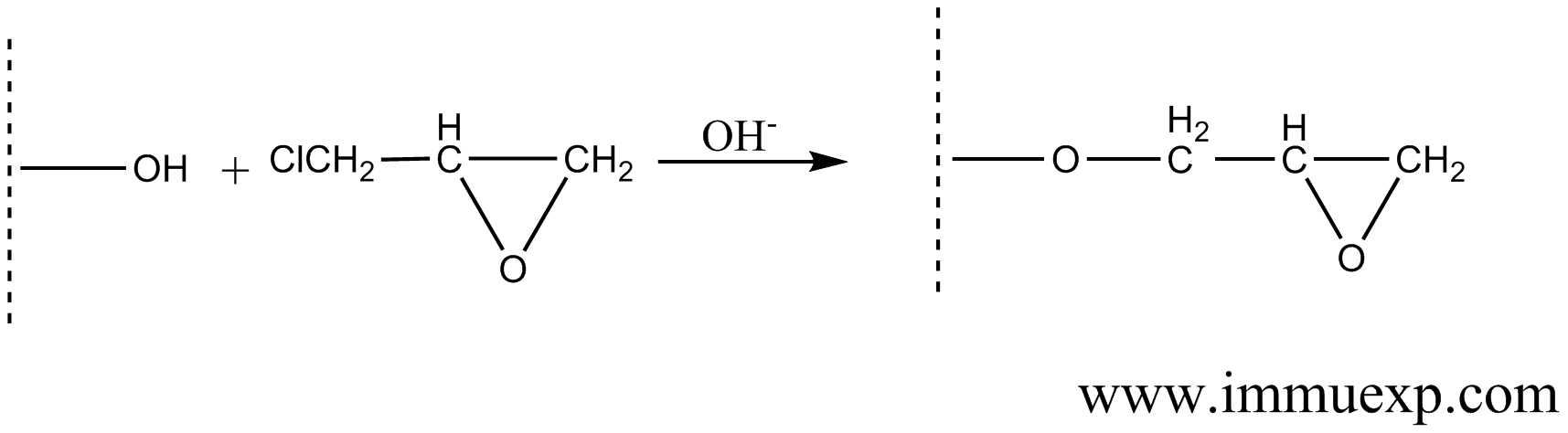
1、介质的制备。目前大部分亲和柱介质都是基于琼脂糖(Agarose)或者葡聚糖(Dextran)。由于琼脂糖稳定性好、对蛋白质的非特异性吸附低、适宜活化,因此是制备抗原亲和柱填料的理想材料。单纯的琼脂糖是不能和蛋白质直接相连的,因此需要给它加一个有活性的臂,这就有点类似多肽与载体蛋白的偶联需要一个双功能试剂一样。琼脂糖加臂(活化)的方法比较多,其中涉及的原理也和多肽与载体蛋白偶联类似,最常用的活化试剂是溴化氰和环氧氯丙烷,另外二溴丙醇、N,N'-羰基二咪唑、双环氧化物等也可以用来活化琼脂糖。
溴化氰对琼脂糖的活化机理如下:
环氧氯丙烷活化机理如下:
关于如何操作的问题,可以参考文献,也可以在本站论坛和大家交流(等本站完成,站长将会陆续上传文献至论坛)。如果你想自己制备,为了你和他人的安全,请不要使用溴化氰活化,溴化氰有剧毒,极微量的摄入都有可能造成死亡,本站对此类事故不负任何责任。如果是单纯做一次或几次小量抗原亲和纯化,建议购买商品化的填料,GE Healthcare就有卖的(Cat. NO.为17-0430-01)。 以下的介绍就基于此填料说明书展开叙述的。使用此种填料首先需要将其进行预处理,预处理方法是:称取适量的beads(一般0.5g beads可以一次性纯化10ml左右血清,可以反复使用)倒入pH 2.0 HCl中,四度让其吸胀15min,体积膨胀比例为:1g可以膨胀至3.5ml,然后将其装入漏斗中,用pH2.0 HCl充分洗涤(体积为beads膨胀后的50倍以上)以除去保护剂。千万不可用中性或碱性试剂洗涤,否则beads会水解。
2、抗原与填料的连接 这一步是整个纯化过程中最关键的一步,如果在这一步上有什么失误,建议你从step one重新开始吧。 首先要注意一点:常见的连接方法都基于抗原上的游离氨基或者巯基与活化后的beads的连接,因此体系中不应该有其它含有氨基或巯基的化合物,包括尿素、硫脲、盐酸胍、Tris、铵根离子、Beta-巯基乙醇等,如果有这些物质在体系中,应该首先设法除去。
溴化氰活化的琼脂糖与氨基化合物反应的机理如下:
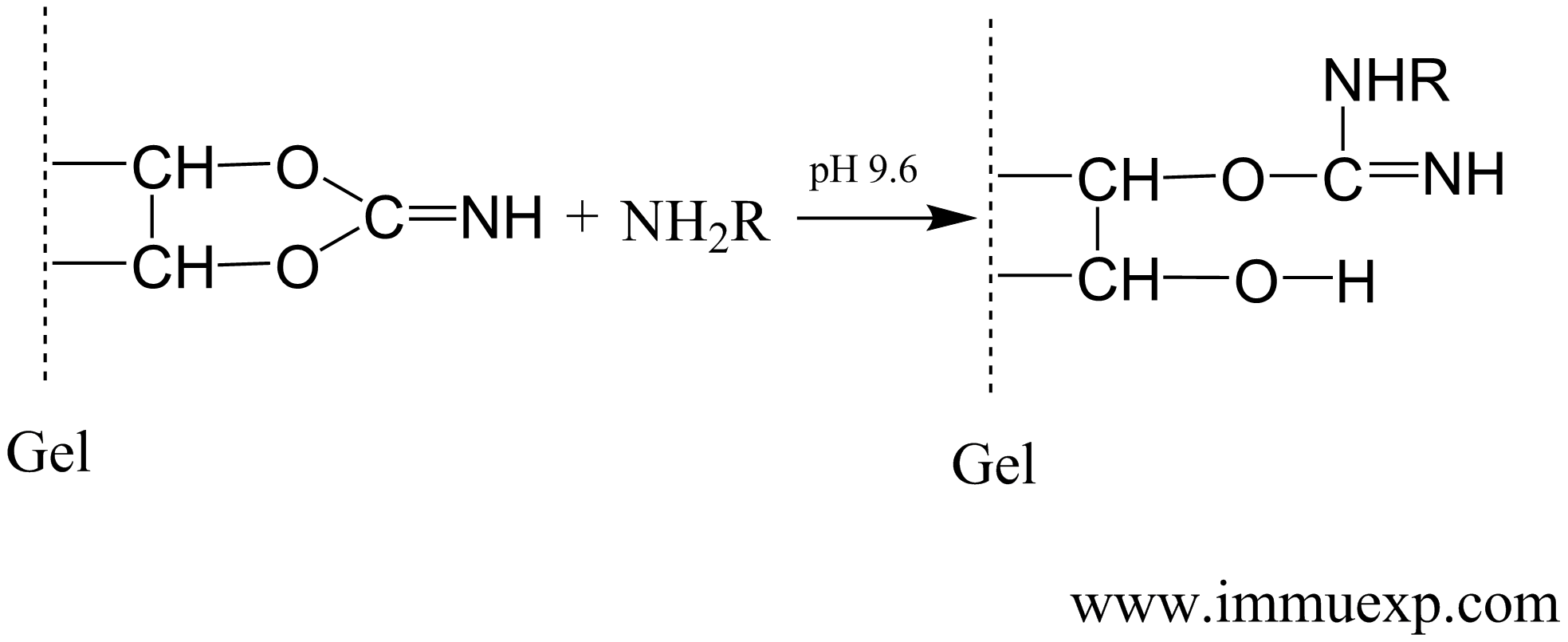
环氧氯丙烷活化的琼脂糖与氨基化合物反应的机理如下:
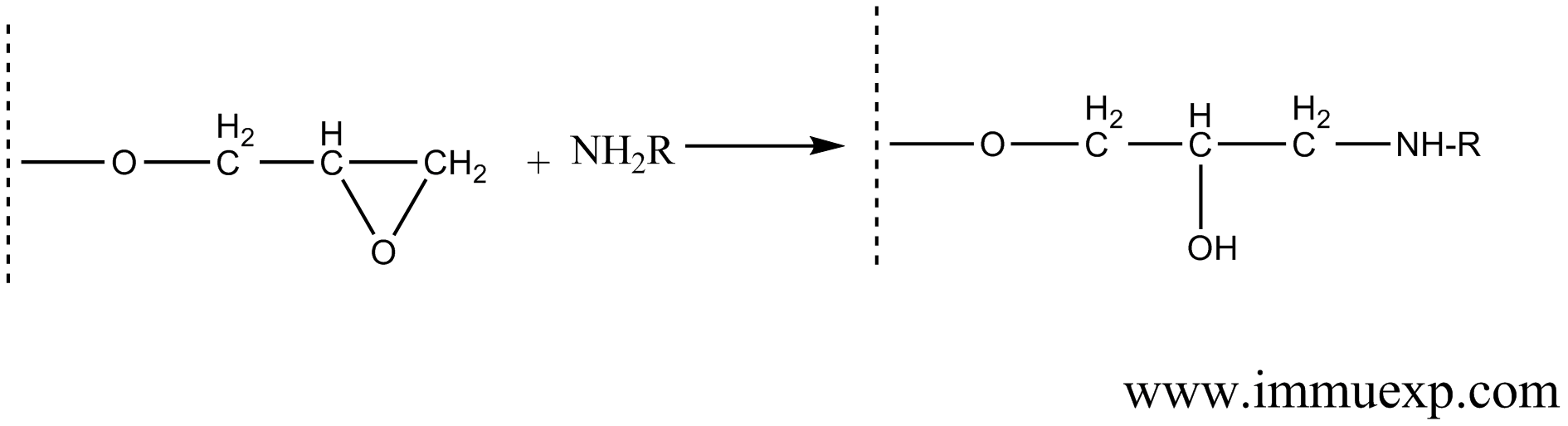
连接反应进行的条件:(1)Buffer体系。上述两个连接反应都应该在碱性环境下进行。pH宜在8-10之间,推荐使用Na2CO3-NaHCO3体系,pH尽量偏离蛋白的等电点,但不可高于10,否则填料很容易水解。pH也不能过低,否则抗原的氨基或巯基会被质子化,无法与beads结合。也可以考虑用其它的缓冲体系,但是绝对不可引入带有游离氨基或者巯基的化合物。为了防止蛋白类抗原的聚集,体系中还可以加入0.5M NaCl以提高盐离子浓度。(2)蛋白质浓度。为了达到比较快而且比较彻底的反应,抗原浓度应尽量提高(也就是高中课本上讲的勒沙特列原理),但过高的浓度有可能造成聚集形成沉淀。一般推荐浓度是5-10mg/ml。需要注意的是beads的承载量并没有这么大。用来连接的蛋白在buffer体系中必须完全溶解,如果不能溶解可以尝试加入去垢剂,多肽等小分子化合物可以用DMSO、DMF、二氧六环助溶。(3)反应温度与时间。此反应可以在室温进行,一般来说,室温4小时反应足够完成,如果担心抗原降解,可以在4℃进行,需要过夜反应。
3、连接效果的评估 有经验的同仁这一步基本可以不做,但是对于新手来说做了这一步心里更有谱一些。这个过程尽量用比较简单的实验来做比较好,推荐使用考马斯亮蓝法(Bradford法),但是体系中如果含有去垢剂,建议改用其它的方法(如BCA,Lowery、凯氏定氮法等),也可以取连接后的上清液(离心后)拿去做SDS-PAGE判断。确认连接没有问题后,以将体系转入柱子里除去连接后的液体,如果没有柱子,也可以用离心的方法进行,下同。
4、多余位点的封闭 为了保证连接效率,beads的量通常是过量的,因此连接完后,beads上就有很多多余的空位点,如果不把它们封闭,那接下来的一步里就会与血清中的抗体结合,这样就会影响抗体得率。 含有氨基的小分子化合物都可以用来进行封闭,如尿素、Tris、乙醇氨、单一氨基酸,大分子物质是不适宜用来封闭的,因为它们的空间位阻会影响下一步中抗体与抗原的结合。封闭条件与连接条件基本类似。封闭完成后,除去封闭液,用PBS洗柱三次。
5、抗血清与beads的结合 血清事先经过10000g 离心5min,有条件的还可以通过0.45um滤膜过滤。将血清用PBS稀释一倍,然后加入连好抗原的beads,密封好,4℃摇晃过液或者室温摇晃3至四小时,摇晃时最好能颠倒来回摇动,确保所有beads都能悬在液体中。室温孵育时间不宜过长,否则会引起非特异性吸附,同时影响抗体质量。
6、非特异性结合的抗体的洗涤 第5步完成后,过柱或者离心去掉血清成份,用PBS洗涤三次。然后再用一个稍稍Harsh一点的体系去洗掉与抗原非特异性结合的蛋白,怎么样的体系算是比较Harsh呢? 一种是偏酸或偏碱一点的pH,可以加酸或加碱将PBS或生理盐水的pH调至偏酸(5.0)或偏碱(8.5)作为洗涤液,用10倍柱体积洗柱一次,也可以直接用150mM Gly,基本不用调pH就是pH=5.0了。另一种体系是高盐离子浓度,例如可以在PBS里加入NaCl至终浓度为1M,10倍柱体积洗涤一次。两种体系的本质都是减弱蛋白质分子间的作用力。
7、洗脱 经过第6步的操作后,结合在柱上的抗体就非常纯了,同时那些亲和力弱的抗体也被洗掉,于是可以开始洗脱了。洗脱方法和上面的洗涤原理基本类似,只是条件更苛刻一点。通常用得比较多的办法是用pH 2.5左右的HCl(含150mM NaCl)洗脱,也可以采用碱性洗脱液洗脱。洗脱有两种方式,一种是连续洗脱,另一种是不连续洗脱。前者是连续入加洗脱液,即时监控洗脱情况并随时决定收集目的抗体组分。不连续洗脱则是分批加入洗脱液,分批收集洗脱流出的成份,最后再对每一次收集的组分检测。如果用前一种方法,最好有一台紫外监测仪检测流出组分以便即时监控,后一种方法的检测则相对比较简单一些,只要是可以对蛋白质进行定量的方法都可以使用(如Bradford法、Lowery法、BCA法等都可以),总之就是越简单越好。洗脱过程尽里在低温完成,洗脱下的组分应该在冰盒上放置,洗脱下来后的成份应该立即调节pH至中性,调节pH应该使用缓冲液,而不应该直接使用强酸或强碱,Na2HPO4、Na2CO3和Tris等缓冲液是用来作为中和液的不错选择。需要指出的是,如果需要将抗体进行偶联荧光素或者酶的时候,就不能使用Tris作为中和液,否则会影响后面的边接效率。
8、抗体的保存 抗体纯化完后,必须采取合适的保存,否则很容易就失去活性。总的来说有这么几个方面需要注意:(1)缓冲体系。纯化后的抗体必须处于一个相对接近体液的缓冲体系中,一般的PBS体系就足够了。注意不要引入高浓度的离子,尤其是金属离子。不要引入干扰抗体实验的离子或基团。(2)防腐剂。为了防止抗体长菌,必须加入防腐剂,常见的防腐剂有:叠氮钠、硫柳汞、抗生素(庆大霉素)。叠氮钠的常用浓度是0.02%,硫柳汞和庆大霉素的常用浓度为0.01%,其中叠氮钠会抑制HRP酶活性,因此在需要偶联HRP酶的抗体中不能加这种防腐剂,而且叠氮钠会影响细胞色素氧化酶活性,会干扰机体的呼吸作用,因此操作时需要注意安全。 硫柳汞对儿童具有潜在毒性,使用时也应注意。(3)稳定剂。向抗体中加入稳定剂可以大其稳定性,常见的稳定剂有多羟基类化合物(二元醇、三元醇等,如浓度为30%-50%的甘油、乙二醇)、二糖类物质(如蔗糖、海藻糖等)、氨基酸、蛋白质(如BSA等),如果抗体需要进行标记,则不可以加入氨基酸、BSA等保护剂。(4)温度。长期不用时,抗体应该低温保存,一般采用-20℃保存。短期不用可以放在4℃,但不要超过一周。抗体绝对要避免反复冻融,前面提到的加入甘油等既可以起稳定作用,还可以起防冻的作用。如果有条件,可以把抗体进行冷冻干燥形成冻干粉,放在-80℃。如果抗体尚未纯化,直接以血清的方式保存在-20℃以下,也可以很好地保证其活性。(5)浓度。和普通蛋白质一样,浓度越高就越利于保存。如果抗体浓度太低,可以采用超滤、protein A或Protein G(操作方法参考单抗纯化相关介绍)、透析袋等方式浓缩。超滤的方式操作简单,直接将抗体装入超滤管再进行离心即可。透析袋浓缩操作也比较简单,将PEG(分子量大于8000)配成50%左右的溶液,用合适孔径的透析袋装好抗体,然后放入PEG溶液中搅拌浓缩即可。关于Protein A或Protein G浓缩的方法将在单抗纯化相关页面讲述,需要指出的是这用这两种亲和柱浓缩的损失可能比较大。(6)存储时间。抗体在-20℃并含有甘油的情况下可以存放数年至十几年(不要反复拿至温室)。在4℃存放的时间一般在一个月左右就可以有明显的效价变化。冷冻干燥的冻干粉低温可放置几十年。
<----返回目录--->
这一部份讲的内容比较多,具体操作方面只是带过,希望读者能通过原理能够进行自行设计实验,既可以随机应变,也可以提高实验设计的思维。如果还有什么问题,可以加入中国免疫学实验网QQ群:42654080。需要文献的朋友请先在本站论坛上发帖,站长将陆续上传资料。

